(资料图片仅供参考)
(资料图片仅供参考)
核酮糖-1,5-二磷酸羧化酶-加氧酶(RuBisCO)是世界上最丰富的蛋白质,采用多重组装,尽管其不同寡聚状态的起源和分布仍然是个谜。现在,研究人员展示了参与光合作用的酶的进化如何导致分子组装的惊人多样性,并且蛋白质可以比以前想象的更容易地改变它们的结构排列。
“这篇论文的重大发现是存在很多结构可塑性,”加州大学伯克利分校助理教授PatrickShih博士说。“在整个领域,蛋白质可能比我们想象的要灵活得多。”
该团队使用传统晶体学(一种能够达到原子级分辨率的技术)结合另一种结构解析技术小角度X射线散射(SAXS),研究了在细菌和一部分光合微生物中发现的一种RuBisCO(II型)),它的分辨率较低,但可以拍摄处于液体混合物中的天然形式的蛋白质快照。SAXS具有高通量能力的额外优势。
以前的工作表明,在植物中发现的研究更深入的RuBisCO类型(形式I)总是采用八个大蛋白质单元和八个小单元排列的“八聚体核心”组装,而形式II被认为主要作为二聚体存在六单元六聚体的一些罕见例子。在使用互补技术检查来自不同微生物物种的RuBisCO样本后,作者观察到大多数形式IIRuBisCO蛋白质实际上是六聚体,偶尔有二聚体,他们发现了一个前所未见的四聚体(四个单元)集会。
将这些结构数据与各自的基因序列相结合,团队可以进行祖先序列重建——一种基于计算机的分子进化方法,可以根据从它们进化而来的现代蛋白质的序列和外观来估计祖先蛋白质的样子。
重建表明,II型RuBisCO的基因在其进化史上发生了变化,产生了具有一系列结构的蛋白质,这些结构可以很容易地转变为新的形状或恢复到旧的结构。相反,在进化过程中,选择压力导致了一系列变化,这些变化将IRuBisCO锁定在适当的位置(结构性防御),这就是为什么八聚体组装是唯一可见的排列。根据作者的说法,假设随着时间的推移,大多数蛋白质组装体都会通过选择压力来巩固其功能以完善其功能,就像我们在I型RuBisCO中看到的那样。但这项研究表明,进化也可能有利于灵活的蛋白质。
完成祖先序列重建后,该团队进行了突变实验,以了解改变rubisco组装(在这种情况下将六聚体分解为二聚体)如何影响酶的活性。出乎意料的是,这种诱导突变产生了一种更善于利用CO2的RuBisCO形式。所有天然存在的RuBisCO经常意外地结合相似大小的O2分子,从而降低酶的生产力。对农业植物物种中的RuBisCO进行基因修饰以增加蛋白质对CO2的亲和力以生产更高产和资源效率更高的作物引起了极大的兴趣。为此,人们非常关注蛋白质的活性位点。
“这对我们来说是一个有趣的见解,因为它表明,为了在RuBisCO工程中取得更丰硕的成果,我们不能只看最简单的答案,即实际与CO2相互作用的酶区域,”AlbertLiu说,Shih实验室的研究生。“也许在该活性位点之外存在突变,它们实际上参与了这项活动,并可能以我们想要的方式改变蛋白质功能。因此,这确实为未来的研究打开了大门。”
下一篇:最后一页
- 用塑料杯喝水会对身体有什么危害?水杯pp和pc哪个更安全?
- 海澜之家(600398):短期环比改善 长期战略引领、革新向前 前沿热点
- 绿地控股:筹划非公开发行股票 募资用于保交楼相关项目
- 准新郎酒驾被查 没想到这已经是第四次了
- @千万郑州人,今后非机动车违法采取新办法,需现场朗读“承诺书”
- 4月河南物价水平保持温和上涨
- 被车评人集体声讨的保时捷终于妥协:免费恢复功能,延保一年
- 郑州市经开区率先部署15分钟核酸检测“采样圈” 记者实探经北一路核酸采样工作站
- 最新全国疫情中高风险地区名单:全国现有高中风险地区15+64个(统计时间:5月19日6时)
- 北京疫情最新消息|5月18日北京新增50例本土确诊病例和5例无症状感染者
-

上海疫情最新消息|5月18日上海新增本土确诊病例82例和本土无症状感染者637例
据上海市卫健委:5月18日0—24时,上海新增本土新冠肺炎确诊病例82例和无症状感染者637例,其中48例确诊病例为既往无症状感染者转归,34例
-

郑州限号|今天是2022年5月19日,郑州限行尾号是4和9
-
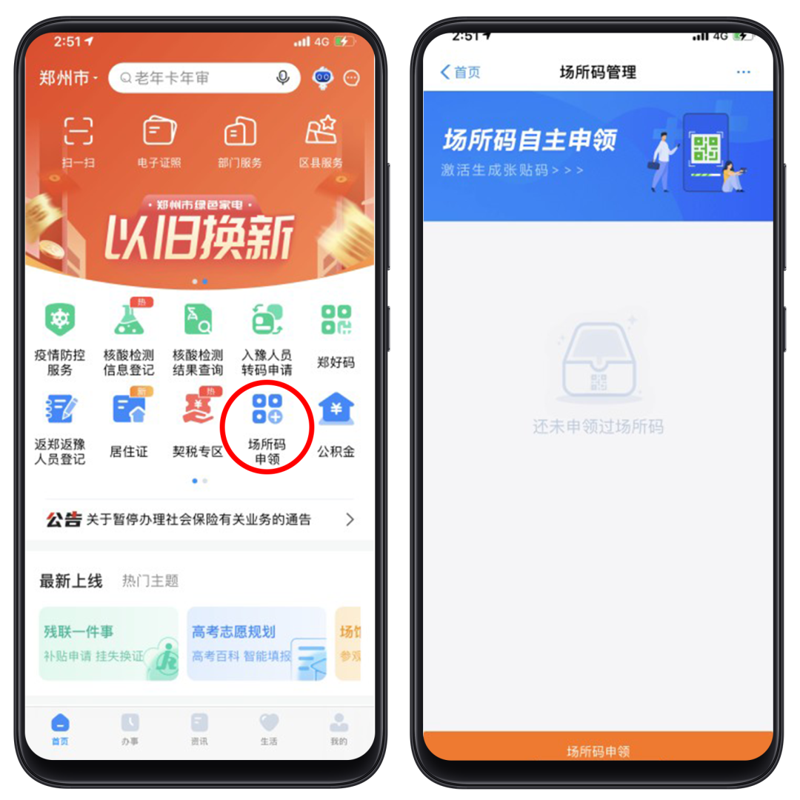
发码总数超68万!郑州市“场所码”覆盖精度再提升
5月18日,记者在郑州市区的多家商超看到,除了商超大门外,商场内部不同楼层、柜台、餐饮店等区域入口处也都张贴了场所码。消费者扫码进入
-

国际博物馆日 河南省南阳市多家博物馆开展线上线下活动
5月17日,河南省南阳市博物馆,游客在观看春秋时期的青铜壶。5月18日是国际博物馆日,河南省南阳市多家博物馆开展线上线下活动,让游客感受
-

南水北调河南段如何成为贯通古今的文脉?
一条渠,绵延千里北上,滋润人间心田。2014年12月12日,南水北调中线工程正式通水。从此,甘甜可口的长江水奔腾不息地流经1432公里,流进千
X 关闭
X 关闭